Safety Report: دموع Zericare & Delsam Pharma الاصطناعية - تم سحبها بسبب التلوث الميكروبي المحتمل, USA
منذ سنتين •source fda.gov
Recall notice
United States
تقوم شركة Global Pharma Healthcare طواعية بسحب جميع الكميات قبل انتهاء صلاحية قطرات العين المزلقة للدموع الاصطناعية، التي وزعتها /Ezricare, LLC- و Delsam Pharma، إلى مستوى المستهلك، بسبب التلوث المحتمل. نبهت مراكز السيطرة على الأمراض والوقاية منها (CDC) إدارة الغذاء والدواء الأمريكية (FDA) إلى التحقيق في مجموعة متعددة الحالات من ميتالو-بيتا-لاكتاماز (VIM) بوساطة فيرونا إنتيغرون - وجيانا-الطيف الموسع بيتا لاكتاماز (GES) - مما يؤدي إلى إنتاج عدوى Pseudomonas aeruginosa (VIM-GES-CRPA) المقاومة للكاربابينيم والتي يُحتمل أن تكون مرتبطة باستخدام الدموع الاصطناعية التي تصنعها شركة جلوبال فارما للرعاية الصحية. حتى الآن، هناك 55 تقريرًا عن أحداث سلبية بما في ذلك التهابات العين وفقدان الرؤية الدائم والوفاة بسبب عدوى مجرى الدم. تم توزيع المنتج على الصعيد الوطني في الولايات المتحدة الأمريكية عبر الإنترنت.بيان المخاطر: يمكن أن يؤدي استخدام الدموع الاصطناعية الملوثة إلى خطر التهابات العين التي قد تؤدي إلى العمى.
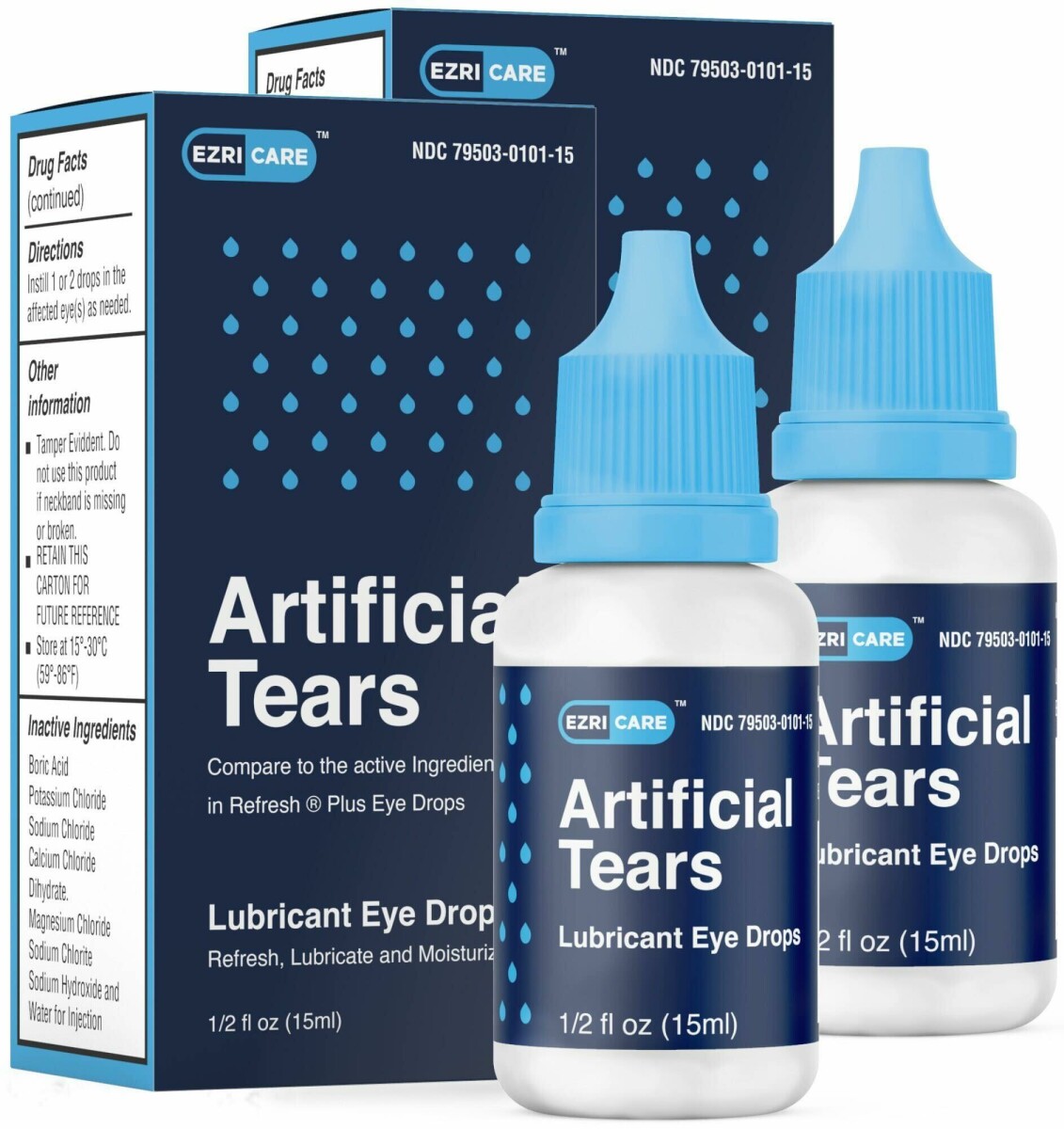
دموع اصطناعية (كربوكسي ميثيل سلولوز الصوديوم) تُستخدم قطرات العين المُزيقة، 10 ملجم في زجاجة 1 مل، ½ أوقية سائلة (15 مل) كحماية ضد المزيد من التهيج أو لتخفيف جفاف العين للتخفيف المؤقت من الانزعاج الناتج عن التهيج الطفيف للعين، أو التعرض للرياح أو الشمس. يتم تعبئة المنتج في زجاجة بختم أمان ويتم وضعها في صندوق كرتوني. يمكن التعرف عليه من خلال الصور أدناه.
- إزريكير إن دي سي 79503-0101-15. عدد مرات المشاهدة 3 79503 10115 7
- NDC 72570-121-15 من شركة ديلسام فارما. يو بي سي -72570-0121-15.
تقوم Global Pharma Healthcare بإخطار موزعي هذا المنتج، Aru Pharma Inc. و Delsam Pharma وتطلب من تجار الجملة وتجار التجزئة والعملاء الذين لديهم المنتج المسحوب التوقف عن الاستخدام.
يمكن للمستهلكين الذين لديهم أسئلة بخصوص هذا الاستدعاء الاتصال بالموزعين: Aru Pharma/Ezricare، LLC. يجب على المستهلكين الاتصال بالطبيب أو مقدم الرعاية الصحية إذا واجهوا أي مشاكل قد تكون مرتبطة باستخدام هذه المنتجات الدوائية التي لا تستلزم وصفة طبية.
في حالة تعرضك للضرر من هذا المنتج، من المهم الإبلاغ عنه. يمكن أن يساعد في اكتشاف المشكلات وحلها ومنع الآخرين من التعرض للأذى، كما أنه يتيح مراقبة أفضل. إذا استمرت الأعراض، فاطلب الرعاية الطبية.
اسم الشركة: جلوبال فارما للرعاية الصحية
اسم العلامة التجارية: إزريكير وديلسام فارما
تم استدعاء المنتج: قطرات تشحيم العين الاصطناعية
سبب الاستدعاء: التلوث الميكروبي المحتمل
تاريخ استدعاء إدارة الغذاء والدواء: 02 فبراير 2023
المصدر: www.fda.gov/safety/recalls-market-withdrawals-safety-alerts/global-pharma-healthcare-issues-voluntary-nationwide-recall-artificial-tears-lubricant-eye-drops-due
تعليقات
تعليق